Desnudando al virus
Coquetea entre mosquitos y humanos. Con sus cuatro versiones se da el lujo de confundir al sistema inmune. Y hasta corre sangre por su engaño. ¿Podemos evitarlo? Saber cómo actúa el virus del dengue nos da más chances de dar en el blanco. Pero a veces ni eso alcanza.

El dengue no es exclusivo de regiones de bajos recursos y cada vez son más los países con casos reportados de la enfermedad. Esta expansión y crecimiento atrajo el interés de las compañías farmacéuticas y con ellas mayores inversiones. Foto: CDC/ Prof. Frank Hadley Collins
Calor, humedad, mosquitos e incertidumbre. Se agudiza el oído, se está atento a la piel. Se revisa y se busca. ¿Habrá? Y los que están ¿serán? Aedes aegypti, digo. Ya es de noche. Tarde para ellos. Pero el vecino de al lado se contagió y el de enfrente también. Y se termina compartiendo. Noticias, opiniones y seguramente algún que otro Aedes… No duermo. Y no por los zumbidos. El que te despierta de madrugada no transmite el dengue. Pienso en el virus.
Un virus que pertenece a la familia Flaviviridae, famosa por tener además entre sus miembros a los responsables del zika y de la fiebre amarilla, y que se caracteriza por infectar a células del sistema inmune. Al virus del dengue, y sus 4 versiones o serotipos, DENV1 a DENV4, le va muy bien entrando y multiplicándose en lo que constituye la primera barrera de defensa del cuerpo, las células fagocíticas de la piel. Células anfitrionas si las hay. Son las que toman contacto con el virus recién salido de la saliva del mosquito, lo tragan y lo presentan formalmente a aquellos glóbulos blancos más eficaces para combatirlos. Sí, leyó bien. Lo presentan. Así se lo llama al proceso en el cual se activan células específicas en las que recae la eliminación definitiva del patógeno.
Ahora bien. Al infectar a las células fagocíticas, el virus del dengue estaría afectando a uno de los principales actores de toda respuesta inmune. Los especialistas coinciden en responsabilizar al DENV de disminuir la maduración y activación de estas células, de alterar su tarea presentadora o, lo que es peor, de inducir su muerte. Como parte de sus mecanismos de evasión del sistema inmune el DENV logra, además, disminuir la producción de sustancias químicas esenciales en las defensas antivirales del cuerpo, como interferón y óxido nítrico, e incluso reducir la respuesta a ellas.
La buena noticia es que, a pesar de todos los intentos del DENV, el sistema inmune puede ganar la primera batalla. No todas las células fagocíticas mueren frente al virus. La activación de glóbulos blancos específicos y, en especial, la producción y acción de anticuerpos neutralizantes –moléculas que se unen a partículas virales permitiendo su eliminación– en general logran controlar una primera infección. Y de esta batalla es posible, aunque no siempre, que nos enteremos. Durante esta respuesta, aumenta significativamente la producción del llamado Factor de Necrosis Tumoral o TNF junto a otras sustancias que incrementan la temperatura corporal y bien pueden hacerse cargo de los síntomas de la llamada fiebre del dengue.
Que no se repita
Temperatura más que agradable para estar sentados en el patio compartiendo un mate con amigos. Macetas y vasijas de barro con agua de la última lluvia acompañan la puesta de sol. Y allá por lo bajo, cerquita de los tobillos, andan los Aedes. ¿Estarán infectados? Y si lo están ¿con qué variante del dengue? Las hembras esperan el momento de tranquilidad preciso para posarse y picar… Siento el pinchazo y casi de inmediato viene el recuerdo de la primera infección.
A menos que nos toque el mismo serotipo en suerte, en una segunda infección con cualquiera de las otras tres variantes del DENV podría darse el fenómeno denominado potenciación de la infección mediada por anticuerpos, ADE por su sigla en inglés. Proceso que revela un acto de infidelidad o, mejor dicho de reacciones cruzadas bastante común en el mundo inmunológico. “Se generan anticuerpos sub-neutralizantes. Es decir, aquellos anticuerpos que actuaron contra un serotipo en una primera infección, ahora reconocen a los demás, pero no los neutralizan”, explica Cybele García, investigadora del CONICET. “Y la interacción de la partículas virales con estos anticuerpos facilita la entrada de esos virus a las células, aumentando su replicación”, agrega.
A este fenómeno ADE se lo responsabiliza, además, de incrementar y agravar los mecanismos de evasión del virus y los síntomas observados durante la primera infección. Hay una desregulación clara de la respuesta inmune en donde disminuye la producción y respuesta a antivirales naturales como interferón y, por otro lado, aumentan desproporcionadamente los niveles de aquellas sustancias, como TNF, responsables no sólo de la de la fiebre, sino del incremento en la permeabilidad vascular. En otras palabras, el virus logra replicarse a sus anchas, mientras que la temperatura sube y la sangre empieza a escurrirse de los vasos sanguíneos. Asoma, de esta forma, una versión más severa de la enfermedad: el dengue hemorrágico.
Los casos particulares de dengue hemorrágico en bebés recién nacidos de madres infectadas también pueden ser explicados por el fenómeno ADE. Los anticuerpos neutralizantes contra el serotipo con el que se infectó la madre pasan a través de la placenta a sus hijos, quedando expuestos así a un desarrollo grave de la enfermedad frente a una infección con un serotipo diferente a partir del mosquito.
A estos anticuerpos sub-neutralizantes se los puede culpar, además, de no contar con una vacuna ampliamente distribuida y con eficacia comprobada en todas las regiones afectadas. Para que la vacuna sea efectiva, debe proteger contra las cuatro versiones del virus. Es decir, hay que fabricar una vacuna tetravalente. La vacunación funciona como una primera infección, que si no es eficaz contra todos los serotipos, en lugar de protegernos nos expone a un riesgo mayor de dengue hemorrágico. “La única vacuna que llegó al mercado, y con una distribución acotada, es la de Sanofi Pasteur. Y les llevó veinte años desarrollarla por el riesgo de reinfecciones y la cocirculación de los cuatro serotipos en las regiones”, relata García, quien también es docente del Departamento de Química Biológica Exactas-UBA.
Pero la cuestión no termina acá. Leer lo que sigue de corrido y sin parar da una idea de cómo la situación, sin asistencia, puede complicarse rápidamente y, a veces, sin retorno. El aumento de carga viral permite la infección de más células fagocíticas presentes en diversos órganos como ganglios linfáticos, bazo, pulmones e hígado favoreciendo una mayor cantidad de procesos inflamatorios. El exceso de TNF y otras sustancias inducen un aumento en el diámetro de los vasos sanguíneos, provocan daños, e incluso la muerte, de las células que forman estos conductos, finalizando con una fuga permanente de plasma. Hay disminución de plaquetas y glóbulos blancos. El aumento de anticuerpos contra el virus favorece la aparición de nuevas reacciones cruzadas. Esta vez atacando estructuras de nuestro propio cuerpo, como células del hígado, componentes de los vasos sanguíneos y proteínas de la sangre relacionadas con la coagulación. Se van sumando, así, diversos procesos inmunológicos que pueden concluir en hemorragias severas y generalizadas, hipotensión y falla circulatoria con un desenlace conocido como síndrome de shock por dengue.
Pero ¿de qué depende llegar a estos cuadros? “No sólo de las reinfecciones. También va a depender mucho de la situación inmunológica del paciente y la virulencia de la cepa circulante, pudiendo llegar, incluso, a síntomas de dengue hemorrágico en una primera infección”, explica García. Se cree, entonces, que está dado por varios factores. En este sentido se sabe, además, que existen diversas susceptibilidades a la infección con dengue y a las respuestas que implican mayores riesgos. Hay variaciones genéticas en la población que pueden favorecer más o menos la entrada del virus a las células fagocíticas, la entrada del complejo DENV-anticuerpos en las segundas infecciones e incluso diferencias en los niveles y efectos del TNF que favorece las grandes hemorragias.
“En 2009 en Argentina tuvimos un brote importante donde circularon varios serotipos y hubo casos de dengue hemorrágico. Este año, afortunadamente, no se reportaron casos de mortalidad, a pesar de que es muy probable que mucha gente en el norte del país lleve infecciones recurrentes, prácticamente continuas desde 2009 hasta ahora”, aclara la investigadora. “De todas formas, sigue siendo un problema grave porque la gente deja de ir a trabajar, está postrada en la cama durante dos semanas, incluso muchas veces los síntomas persisten durante veintiún días”, explica la experta.
Es una enfermedad que crece. García y otros especialistas, como Elsa Damonte, investigadora del CONICET y profesora de Exactas-UBA, coinciden en que el dengue se expande por el mundo y junto con él, las formas más severas de la enfermedad. También acuerdan en que no hay, hasta el momento, un tratamiento antiviral efectivo y aprobado. Para dengue esto no es tan fácil.
Dar en el blanco no alcanza
El diseño de antivirales es como un juego de tiro al blanco. Cada paso que el virus da una vez dentro de nuestro cuerpo se convierte en un posible destino contra el cual el compuesto podrá actuar. El objetivo siempre es el mismo: evitar que el virus haga copias de sí mismo.
Entonces, cuánto más sepamos sobre DENV y su ciclo de replicación más chances tenemos de ganar la batalla. Sabemos que cuenta con una envoltura, de estructura similar a las membranas celulares, y que en esa envoltura tiene la proteína que hace de llave de entrada a nuestras células fagocíticas. Se llama proteína E. Debajo de esa envoltura, casi como otra capa de cebolla, tiene la cápside. Hecha toda de proteínas C, la cápside recubre, protege y atesora al que dirige todo: el genoma viral. Que no es ADN como el de las células del cuerpo humano, sino un ARN que está listo para impartir instrucciones una vez suelto dentro de la célula. A partir de este ARN se fabricarán todas las proteínas virales. Prácticamente eso es todo lo que necesita una partícula de DENV o virión para infectarnos y someternos.
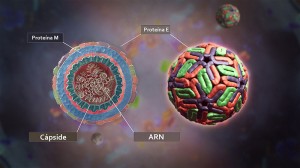
Corte de un virus de dengue que muestra sus componentes estructurales. Girish Khera, Scientific Animations.
Pero ¿cómo lo logra? Primero lo primero: entrar a las células. La proteína E se une a determinadas proteínas que están en la membrana celular y le dan el pase hacia el interior. La envoltura del virus se une a la membrana, entrando a la célula por un mecanismo llamado endocitosis facilitada por un receptor. Una vez adentro de una célula la cápside se desarma y el virus logra así un paso importante: el desnudamiento de su genoma. Una vez libre, es él el que manda. La maquinaria de fabricación de proteínas y material genético de la célula queda a merced del virus. Transforma membranas internas y prepara espacios lipídicos para la replicación de su genoma. Usa las enzimas, la energía y la materia prima celular para hacer copias de su ARN y fabricar las proteínas que forman su estructura y otras que necesita para replicarse. ¿Qué queda entonces? Al igual que en una línea de producción industrial, viene el ensamblado final. Las proteínas C rodean a las moléculas de ARN y estas partículas entran en un sistema de transporte de la célula para recibir su envoltura con la proteína E incluída. Exitosos, los viriones brotan de las membranas listos para infectar nuevas células. Así comienza la invasión.
Diversos investigadores en nuestro país estudian estos mecanismos de replicación del virus. Entre ellos Andrea Gamarnik, directora del laboratorio de Virología de la Fundación Instituto Leloir y ganadora del Premio Internacional L´Oréal-Unesco –Por las Mujeres en la Ciencia–, quien además, estudia la interacción de DENV con células de mosquito y humanas, analizando las estrategias del virus para sobrevivir al cambio de hospedador.
Para ganar la partida, podríamos pensar en apuntarle a la estructura del virus o bien a proteínas de nuestras células que son utilizadas por el DENV. “Dentro de los blancos virales, la mayoría de los estudios están dirigidos a la proteína E para bloquear la entrada del virus a la célula o bien, contra una proteína esencial que el virus utiliza para replicar su genoma”, explica García. Como blancos celulares, los investigadores probaron compuestos que afectan a las enzimas que usa el virus para fabricar sus propias proteínas. “El que llegó a etapas más avanzadas es el “celgosivir”, que fue probado en ensayos clínicos, pero no funcionó. Se están reviendo las dosis y las formas de administración para lograr mayor efectividad”, aclara la investigadora.
Muchos otros compuestos se probaron como agentes antivirales contra dengue. En el Laboratorio de Virología del Departamento de Química Biológica de Exactas-UBA, Damonte estudia, entre otras líneas de investigación, el efecto de “acridonas” como agentes antivirales que bloquean la replicación del genoma del virus. Otra alternativa novedosa es la utilizada por García, junto a Damonte, en el laboratorio especializado en estrategias antivirales. Consiste en analizar la acción de proteínas que actúan como defensas celulares contra el virus. “Lo que hacemos es aumentar estas proteínas para evaluar la importancia de la misma como antiviral celular”, explica.
Tal parece, entonces, que algo de la replicación de DENV sabemos, y que, en principio, nos permite probar algunos tiros al blanco. Al menos en células dentro de los laboratorios de investigación básica. Otro jugador crucial en esta partida lo constituye la industria. ¿Quién podría sino costear las pruebas clínicas en pacientes? “Lo interesante en el caso de dengue es que las compañías se acercaron mucho a la academia, para evaluar los posibles blancos que surgieron del estudio de la ciencia básica, para escalarlos, estudiarlos, y hacer los ensayos clínicos”, revela García.
Los principales participantes parecen estar presentes. Entonces ¿dónde radica la falta de tratamiento hasta la fecha? A este esquema le falta un jugador. García esclarece la duda: “No hay un modelo animal en el que se pueda hacer los ensayos de evaluación de los antivirales. Si bien hay modelos de ratones reportados, son modelos que no representan exactamente la enfermedad, por tratarse de animales modificados genéticamente que tienen alterada la vía de respuesta a interferón para lograr que desarrolle la enfermedad. Entonces, uno hace todos los ensayos in vitro en el laboratorio, hace los estudios bio-informáticos de predicciones, pero entre el laboratorio y el paciente hay un salto enorme”.
Investigar para ganar
Según la Organización Mundial de la Salud (OMS) en los años 2010, 2013 y 2015, se notificaron casi 2,4 millones de casos de dengue por año. En lo que va del 2016, sólo en Latinoamérica hubo alrededor de 250.000 casos en este período corto de verano. En el último Boletín Integrado de Vigilancia publicado por la cartera sanitaria del Ministerio de Salud de la Nación, en las primeras catorce semanas epidemiológicas del 2016, del 03/01 al 09/04, se notificaron 24.879 casos de dengue confirmados o probables autóctonos distribuidos en quince jurisdicciones de la República Argentina. La Ciudad de Buenos Aires con 1579 casos y Provincia de Buenos Aires con 2693 casos, junto a otras provincias, son regiones de transmisión sostenida de dengue.
El otro lado de la balanza no llega a compensar. Por el momento, no hay tratamientos antivirales que hayan pasado exitosamente los ensayos clínicos. La vacuna aprobada es muy reciente y de distribución acotada. Como explica García, salió al mercado en el año 2015 y, si bien es protectiva contra los cuatro serotipos, todavía hay que esperar para evaluar si su efectividad es pareja para todas las variantes, y para las diversas regiones donde se presenta la enfermedad. Por otro lado, es importante aclarar que México y Brasil, son los únicos países de Latinoamérica donde está abierta su comercialización, y también en Filipinas.
El dengue no es exclusivo de regiones de bajos recursos y cada vez son más los países con casos reportados de la enfermedad. Esta expansión y crecimiento atrajo el interés de las compañías farmacéuticas y con ellas mayores inversiones. De todas formas, el dengue sigue perteneciendo a la lista de las llamadas por la OMS “enfermedades desatendidas”. Más del 70% de los países y territorios afectados por estas enfermedades tienen economías de ingresos bajos o medios-bajos. Para la OMS, la prevención y el control de estas enfermedades relacionadas con la pobreza requiere un abordaje integrado, con acciones multisectoriales, iniciativas combinadas e intervenciones costo efectivas para reducir el impacto negativo sobre la salud y el bienestar social y económico de los pueblos. En otras palabras, para ganar la partida sigue haciendo falta decisiones políticas integrales e inversión en salud, educación e investigación.