Duelos celulares
Un grupo de investigadoras e investigadores de distintas áreas de biología celular y molecular acaban de publicar un trabajo donde revelan funciones antivirales hasta ahora desconocidas de una proteína humana. El hallazgo resulta de gran importancia para comprender mejor lo que ocurre en las células cuando el virus del dengue entra en escena.
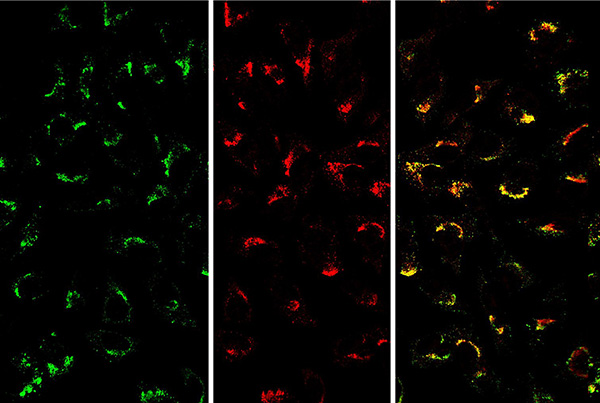
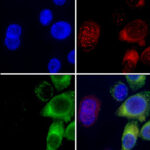
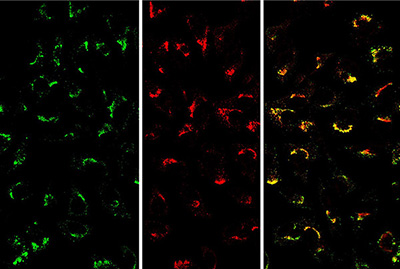
La respuesta inmune en imágenes: dentro de la célula, el genoma viral (verde) se ubica en los mismos lugares que la proteína sensora (rojo). Imagen: Composición a partir de fotos de microscopía de fluorescencia registradas en el Instituto de Fisiología, Biología Molecular y Neurociencias (UBA-CONICET).
Cuando hablamos de virus, en el contexto mundial que nos toca vivir, parece todo dicho: coronavirus. Sin embargo, si la pandemia no hubiera tomado nuestras vidas, hoy, probablemente, estaríamos hablando del virus del dengue: el altísimo nivel de infección que se viene registrando en Sudamérica, incluido en ciudades como Buenos Aires, alumbra sobre esa posibilidad contrafáctica.
El virus de COVID-19, el del dengue, todos los virus, tienen una estrategia infectiva en común, nacida de sus propias limitaciones. El virus contiene un genoma pequeño que no cuenta con toda la información necesaria para generar las herramientas moleculares que necesita para multiplicarse. Pero al infectar los organismos encuentra en las células el hospedador perfecto: se apropia de la maquinaria celular y, a través del ella, logra producir muchísimas nuevas copias de partículas virales que saldrán de esas células para infectar a otras. Por supuesto, las células atacadas hacen frente a la usurpación y se encarna así la lucha entre la célula, con su respuesta antiviral, y el virus, con sus mecanismos de evasión y contraataque.
“Si algunos virus logran infectarnos a niveles tales que nos enferman e incluso pueden matarnos, significa que el contragolpe viral es, en esos casos, bastante efectivo”, sostiene la bióloga Anabella Srebrow, autora, junto a especialistas de otras instituciones, de un trabajo científico recientemente publicado en la revista Nucleic Acids Research, que hace foco en la infección por el virus del dengue. “Nuestro trabajo trata de comprender aún más las estrategias de lucha de los dos contrincantes: la célula humana y el virus. Pudimos demostrar la función antiviral de una proteína celular conocida desde hace tiempo, llamada RBM10, pero no relacionada hasta el momento con ningún aspecto de la virología. En forma resumida, revelamos que niveles elevados de la proteína RBM10 limitan la replicación del virus de dengue en células humanas en cultivo, mientras que su ausencia favorece la replicación viral”, indica Srebrow.
La investigación que resultó en el paper la llevó a cabo el grupo del Instituto de Fisiología, Biología Molecular y Neurociencias (IFIBYNE UBA-CONICET) encabezado por Srebrow, en colaboración con el laboratorio del Instituto de Química Biológica (IQUIBICEN UBA-COCINET) dirigido por Cybele García y el laboratorio a cargo de Andrea Gamarnik de la Fundación Instituto Leloir.
“Con mi grupo nos especializamos en la regulación de la expresión genética, y en particular en el procesamiento del ARN; nuestros colaboradores son expertos en virología. Así que, si bien los tres grupos manejamos muchas herramientas comunes de bioquímica y de biología molecular y celular, hay otras que son más específicas de cada especialidad y que fue muy importante poder compartirlas. Además, algunos de los autores del trabajo han aportado ciertos conocimientos importantes desde el área de la bioinformática”, afirma Srebrow antes de comenzar la entrevista con NEXciencia.
– Con respecto a ese duelo entre el virus y el hospedador, ¿qué mecanismos celulares están involucrados?
– La célula no permanece pasiva frente a la usurpación: advierte el ingreso de un genoma viral como un extraño, y ante su detección desencadena una serie de procesos moleculares tendientes a desactivar al intruso y evitar su replicación. Estos procesos, en su conjunto, llevan el nombre de respuesta celular antiviral, y forman parte de la defensa innata de nuestro organismo. La respuesta antiviral es llevada a cabo por una gran variedad de proteínas celulares, muchas de ellas conocidas y profundamente estudiadas y muchas otras aún en continuo proceso de identificación. Pero, así como la célula despliega mecanismos de acción antiviral, la selección natural ha ido permitiendo la evolución y propagación de aquellos virus que de alguna manera logran evadir, atenuar o interferir la respuesta celular antiviral.
– Pero parece que el virus también ha aprendido a contraatacar…
– ¡Sí! También pudimos demostrar que el virus de dengue parece contar con una estrategia para sacarse de encima a esta proteína celular antiviral, de algún modo logra degradarla. Nuestro trabajo pone en evidencia nuevos actores de los intrigantes mecanismos moleculares que tienen lugar dentro de las células ante la infección viral.
– Ahora sabemos que la proteína RBM10 juega un papel fundamental en la respuesta antiviral. ¿Cómo llegaron a enfocar el interés en ella?
– Sin duda es una pregunta interesante que requiere remontarnos un poco más atrás en el tiempo. En el año 2016, a través de un trabajo en colaboración con el laboratorio dirigido por Andrea Gamarnik, describimos cómo el virus de dengue altera una etapa del procesamiento de los ARN mensajeros de la célula hospedadora, y propusimos que esta alteración resulta beneficiosa para el virus porque el entorno celular se vuelve más permisivo para la replicación viral. A partir de la identificación de un grupo variado de moléculas de ARN mensajeros de la célula hospedadora afectados por el virus, enfocamos nuestro estudio posterior en uno de estos ARN mensajeros, que codifica para una proteína de conocida acción antiviral. Buscando en la literatura, encontramos datos de otros laboratorios que indicaban que RBM10 está involucrada en el procesamiento de este ARN mensajero en particular, y entonces, Berta Pozzi, en ese momento becaria posdoctoral del laboratorio, comenzó a indagar sobre un posible vínculo entre RBM10 y la infección viral. Y así surgió el trabajo recientemente publicado. Encontrar que una determinada molécula tiene otros roles dentro de la célula, diferentes a los originalmente identificados, es algo común de los últimos años de la ciencia, tal vez porque las metodologías y las preguntas fueron haciendo posible revelar funciones nuevas de moléculas o actores conocidos, y no quedarse únicamente en lo que ya sabemos sobre ellos.
– ¿Y qué hace RBM10 para limitar la replicación viral?
– Tal vez eso es lo más difícil de explicar. Lo que nuestro trabajo propone, es que RBM10 estimula la producción de algunas moléculas de ARN mensajero que van a dar lugar a proteínas con acción antiviral. También demostramos que RBM10, mediante un mecanismo que aún desconocemos, favorece la activación de una de las proteínas que funcionan como detector del genoma viral dentro de la célula, lo que consecuentemente favorece la producción y liberación por parte de la célula infectada de moléculas de interferón, actores claves en la respuesta inmune innata.
– ¿La metodología representó un desafío?
– La metodología agrupa una variedad de técnicas bioquímicas, moleculares y celulares de uso relativamente corriente en los laboratorios involucrados. Nuestro laboratorio, en particular, tuvo que aprender técnicas relacionadas al estudio de la infección viral, que nunca habíamos manejado antes, y también tuvimos que aprender las bases de la respuesta inmune innata, para poder definir criterios de trabajo y protocolos experimentales apropiados. Este aprendizaje, sin duda resultó un desafío, sobre todo desde el punto de vista intelectual. Es realmente muy apasionante ir sumergiéndose en temáticas que no formaban parte del “lenguaje” cotidiano del laboratorio, y ver que uno tiene la capacidad de hacer preguntas relevantes y de responderlas experimentalmente de manera exitosa. Obviamente, la articulación permanente con colaboradores expertos en el área de la virología, y en particular de dengue, fue crucial para lograrlo.
– ¿Cuál puede ser la continuidad de esta investigación?
– Sería muy interesante seguir indagando sobre aquellos mecanismos mediante los cuales RBM10 favorece la activación de esta proteína detectora del ARN viral (proteína denominada RIG-I). Además, nos interesa entender si RBM10 juega un rol frente a infecciones por otros virus, no sólo dengue, o incluso frente a otros patógenos. Y, por último, sin duda, nos interesa seguir indagando sobre los mecanismos moleculares mediante los cuales los virus logran modificar el entorno celular en su beneficio.
Todos los nombres del paper
Las investigadoras e investigadores que participaron de la investigación que derivó en la publicación, son los siguientes: Berta Pozzi (1,2) , Laureano Bragado (1,2) , Pablo Mammi (1,2), María Florencia Torti (3,4) , Nicolás Gaioli (1,2) , Leopoldo G Gebhard (5) , Martín E García Solá (1,2), Rita Vaz-Drago (6), Néstor G Iglesias (5) , Cybele C García (3,4) , Andrea V Gamarnik (7) y Anabella Srebrow (1,2).
1 Universidad de Buenos Aires, Facultad de Ciencias Exactas y Naturales, Departamento de Fisiología, Biología Molecular y Celular, Buenos Aires, Argentina.
2 CONICET-Universidad de Buenos Aires, Instituto de Fisiología, Biología Molecular y Neurociencias (IFIBYNE), Buenos Aires, Argentina.
3 Universidad de Buenos Aires, Facultad de Ciencias Exactas y Naturales, Departamento de Química Biológica, Buenos Aires, Argentina.
4 CONICET-Universidad de Buenos Aires, Instituto de Química Biológica de la Facultad de Ciencias Exactas y Naturales (IQUIBICEN), Buenos Aires, Argentina.
5 CONICET-Universidad Nacional de Quilmes, Laboratorio de Virus Emergentes, Departamento de CyT, Buenos Aires, Argentina.
6 Instituto de Medicina Molecular, Faculdade de Medicina, Universidade de Lisboa, Portugal.
7 CONICET-Fundación Instituto Leloir (FIL), Buenos Aires, Argentina.