Un freno a la metástasis
Un equipo de investigadores de la Argentina y los Estados Unidos efectuó un conjunto de experimentos que demuestran que la meta-tirosina, una molécula producida por el propio organismo, podría ser útil para impedir que ciertos tumores humanos se extiendan a otros órganos. Proponen su uso terapéutico y, también, como indicador del pronóstico de la enfermedad.
Cuando se extirpa quirúrgicamente un tumor puede ocurrir que, de manera abrupta, el paciente comience a desarrollar focos tumorales secundarios (metástasis) en otras partes del cuerpo.
Esto se debe a que mientras el tumor primario está presente en el organismo impide que se multipliquen las células cancerígenas que hubieran hecho metástasis en otros órganos. Este fenómeno se denomina “resistencia concomitante” (RC) y fue descripto por primera vez en 1906 por Paul Ehrlich, premio Nobel de medicina, quien postuló que la RC podía deberse a que, para sobrevivir, el tumor primario se apropia de los nutrientes esenciales para crecer y que, de esa manera, inhibe el crecimiento de otros focos tumorales.
Pese a su importancia para la comprensión de la metástasis, el fenómeno descripto por Ehrlich fue olvidado por la ciencia durante más de medio siglo y, todavía hoy, es un tema marginal de investigación.
Desde hace varias décadas, Raúl Ruggiero, investigador del CONICET en la Academia Nacional de Medicina, estudia la RC. Junto con su equipo de trabajo, Ruggiero descubrió que la meta-tirosina, una molécula que sería producida por el tumor primario, es la responsable de inhibir el desarrollo de los focos cancerígenos secundarios.
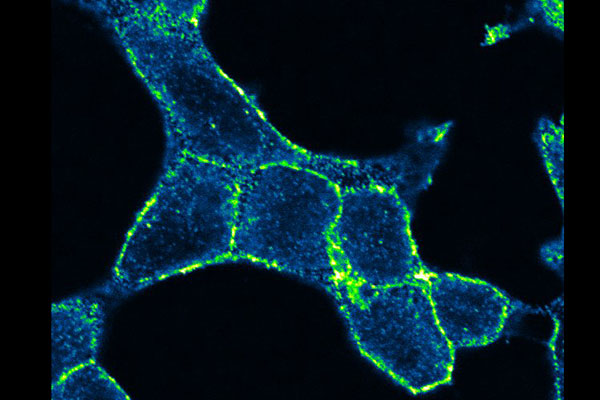
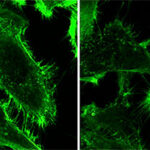
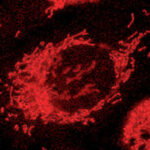
Ruggiero efectuaba sus experimentos con la meta-tirosina en tumores de ratones y, un día, decidió hacer sus pruebas con el cáncer humano. Entonces, se acercó al Laboratorio de Inflamación y Cáncer (LIC) de la Facultad de Ciencias Exactas y Naturales de la UBA donde, desde hace años, estudian tumores de próstata humanos.
“Quisimos comprobar si la meta-tirosina tiene algún efecto en los tumores humanos y ahí nace la colaboración entre los dos laboratorios”, cuenta Geraldine Gueron, investigadora del CONICET en el LIC.
Fruto de esa colaboración surgió un paper científico que acaba de ser publicado en la revista Cell Death and Disease, del grupo Nature: “Es el primer trabajo en el que se demuestra que el fenómeno de resistencia concomitante ocurre en tumores humanos”, afirma Gueron. “También comprobamos que en presencia de estos tumores humanos se libera meta-tirosina”, revela, y añade entusiasmada: “Hicimos crecer un tumor humano en ratones y nos sorprendió observar que ese tumor primario deja de crecer si le inyectamos meta-tirosina a los tumores de ratones”.
Los experimentos fueron repetidos con otros tipos de cáncer humano: “Obtuvimos resultados similares con el tumor de próstata, con un carcinoma nasofaríngeo y con un tipo de cáncer de pulmón”, informa.
Pero esto no fue todo. El equipo de investigación pudo además avanzar en la comprensión del fenómeno de la RC: “Logramos revertir la resistencia concomitante y hacer que los tumores secundarios crezcan”.
Molécula oxidada
Las proteínas están formadas por cadenas de distintos aminoácidos, cuya secuencia particular determina su conformación espacial, es decir, su forma. Si se cambia un aminoácido por otro diferente, puede ocurrir que se modifique la estructura de la proteína y, como consecuencia, que deje de funcionar. Esto puede ocasionar desarreglos en las células, que pueden ver afectada su viabilidad.
La meta-tirosina es un aminoácido. Pero no es uno “normal”. Es el resultado de la oxidación de otro aminoácido, la fenilalanina, que sí es un componente natural de las proteínas. Ruggiero había comprobado en sus ratones que la fenilalanina revierte el fenómeno de RC. Pero no estaba claro el mecanismo.
“Empezamos a revisar trabajos de investigación del campo de la química -recuerda Gueron- y encontramos que se había demostrado que el transfer que normalmente lleva a la incorporación de la fenilalanina a las proteínas, cuando se encuentra con la meta-tirosina se confunde, y puede colocar indistintamente cualquiera de los dos aminoácidos”. De esta manera, la célula empieza a tener cantidades crecientes de proteínas con meta-tirosina en su composición.
“Uno de los recursos que tiene la célula para sacarse de encima estas proteínas oxidadas es la autofagia”, explica Gueron. “Es un mecanismo por el que la célula, para protegerse, reduce su metabolismo al mínimo y se apaga. Queda en un estado durmiente”, aclara. “Nosotros demostramos que, en presencia de meta-tirosina, las células de cáncer de próstata humano recurren a la autofagia, y también comprobamos que la fenilalanina revierte ese estado”, consigna.
Molécula promisoria
Entre los experimentos publicados, uno de ellos adquiere singular relevancia: generaron tumores primarios de cáncer de próstata humano en dos conjuntos de ratones, y a uno de los dos grupos lo trataron con meta-tirosina. Días después estudiaron su evolución.
“Del grupo de ratones que no recibió meta-tirosina casi todos estaban colmados de metástasis y terminaron muriéndose. De los ratones del grupo que recibió meta-tirosina más del 50% seguía con vida, y no tenía metástasis”.
Según la investigadora, “en nuestros experimentos, la administración periódica de meta-tirosina no mostró efectos tóxicos en las células normales, al menos en los órganos de alta proliferación, como la piel, la médula ósea y el intestino
delgado. Tampoco provocó alteraciones significativas en el sistema inmunológico”.
Un estudio que analiza la acción de la meta-tirosina en los seres humanos, efectuado en Gran Bretaña en 1979, indica que esa molécula es metabolizada y eliminada por el organismo a través de la orina sin provocar efectos colaterales. Por eso, Gueron propone que “la meta-tirosina podría ser eficaz como herramienta terapéutica para prevenir la metástasis, especialmente para evitar que las células ‘durmientes’ se activen después de la extirpación de un tumor”.
También, la científica sugiere que el análisis de meta-tirosina en la sangre “podría tener valor diagnóstico y, tal vez, pronóstico”. Para fundamentar su propuesta, Gueron explica que “los ratones que tienen un tumor primario tienen muchísima más meta-tirosina circulando por la sangre que aquellos que no tienen un tumor”.
Todavía quedan muchas preguntas por responder acerca del fenómeno de la RC. De hecho, todavía no se sabe con certeza quién genera la producción de meta-tirosina: “Podría ser el tumor primario, pero también el sistema inmune”.
Menos aun se comprende por qué la meta-tirosina no afecta al tumor primario o a las células normales de la misma manera en que sí afecta a los focos tumorales secundarios: “Tenemos algunas hipótesis, pero todavía tenemos que demostrarlas”, avisa Gueron.
El trabajo publicado en Cell Death and Disease fue financiado con fondos de la Agencia Nacional de Promoción Científica y Tecnológica, de la Universidad de Buenos Aires, del Instituto Nacional del Cáncer de la Argentina, y de la Prostate Cancer Foundation de los Estados Unidos.