Apuntar al blanco
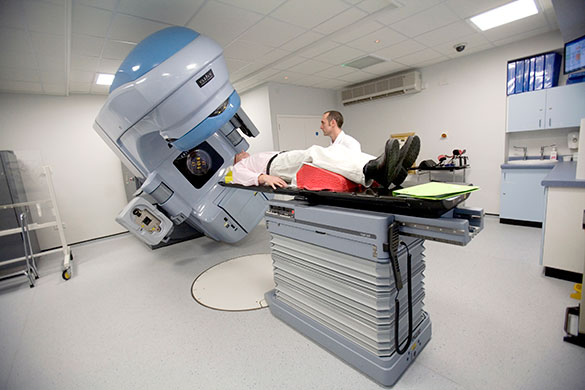
Cuando a un paciente de cáncer se le prescribe radioterapia, los físicos médicos entran en acción; también controlan que se reciba la dosis correcta de radiación al hacerse una radiografía o tomografía computada y participan de programas de estudio para mejorar los tratamientos médicos como la boroterapia y hadronterapia, entre otras tareas.

Los físicos médicos aportan su conocimiento al momento de determinar las dosis correctas de radiación en los casos de tomografías y radiografías.
http://noticias.exactas.uba.ar/audio/DianaFeld.mp3
Descargar archivo MP3 de Diana Feld
Aunque no lo veamos, el físico médico siempre está. O debería estar, porque su ausencia puede llevar a que un paciente reciba dosis incorrectas de radiación al hacerse una radiografía o tomografía computada, lo mismo que el personal que trabaja en esos centros de salud; o no resultar efectivo el tratamiento para un enfermo de cáncer sometido a radioterapia. Es que estos especialistas que combinan conocimientos físicos y médicos tienen entre sus obsesiones dar en el blanco con el menor costo posible.
“El objetivo principal en los tratamientos médicos de radioterapia es entregar la mayor dosis de radiación al tumor y la menor a los órganos sanos. En los estudios de diagnóstico de medicina nuclear como en rayos X, lo que se intenta es entregar la mínima dosis para ver lo máximo”, destaca Diana Feld, directora de la Maestría en Física Médica de la Facultad de Ciencias Exactas y Naturales de la UBA. Ella es una de los 20 mil físicos médicos que existen en el mundo.
Cuando un oncólogo indica a una persona un tratamiento de radioterapia para revertir su enfermedad, entra en escena el físico médico. “A cada paciente que se le prescribe una dosis de radiación, se le diseña su plan de tratamiento con un programa computacional específico donde se ingresan los datos del enfermo y algoritmos de cálculo para procesar esa información”, describe Feld, y enseguida explica el objetivo por seguir: “Los cañones deben apuntar a la lesión, y lo que sería la retaguardia, debe proteger a los órganos nobles”, ejemplifica. La radiación puede destruir el ADN de las células cancerosas y disminuir así el tamaño del tumor.
Fantomas a la vista
Asimismo, esta especialidad apunta a verificar si el equipo de tratamiento responde adecuadamente, si la radiación que debe entregar por minuto es la que corresponde. Para controlar que las radiaciones emitidas por los distintos aparatos médicos sean las adecuadas, estos profesionales recurren a fantomas. “Se trata de modelos que simulan el cuerpo humano. En general son de agua, porque nosotros somos agua. Es como una pecera que tiene dimensiones del cuerpo humano, y se miden las variaciones que hay en la cantidad de radiación que reciben los distintos puntos: en el eje, alejado del eje, para ver si la dosis de radiación se distribuye como queremos”, detalla. “También, -agrega- se hacen fantomas heterogéneos, con distintos órganos, se simula el pulmón con corcho, o los huecos con aire que hay en el cuerpo. No es lo mismo que la radiación se tope con un hueso, aire o tejido blando. Lo que reciba el paciente dependerá de lo que tenga en el camino el haz de radiaciones”.
Algunas de las tareas de esta especialidad es optimizar los tratamientos radiantes; calibrar el equipamiento para asegurar que funcione dentro de los límites recomendables; avanzar en diseños de equipos, así como en incursionar en la hadronterapia. En este caso se usan partículas pesadas tales como el protón (en lugar de fotones y electrones), con el cual se irradia menos el órgano sano situado detrás del tumor. “Por ejemplo, al irradiar una parte del ojo es mejor hacerlo con protones porque llegan hasta un determinado lugar y luego no hay más producción de radiación. Eso es diferente a lo que ocurre con los fotones. Para determinadas lesiones, el protón es muy útil. En nuestro país todavía no lo tenemos y es una posibilidad a desarrollar”, indica Feld, a cargo de la división de física médica de la CNEA.
En tanto, la Terapia por Captura Neutrónica en Boro (BNCT) se lleva adelante en el reactor RA-6 de Bariloche. “En este momento se usa para un tipo de enfermedad, melanoma nodular en extremidades. Se llevaron a cabo ocho tratamientos en pacientes del Instituto Roffo, a cargo de los aspectos clínicos del proyecto. En este momento se hizo un rediseño del haz, por lo que se espera retomar los tratamientos en 2014”, explica.
Un equipo multidisciplinario de biólogos, físicos, químicos, médicos, ingenieros, entre otros, empezó en 1996 a trabajar en este tema, que está en la fase de aplicación aprobado por el Ministerio de Salud de la Nación y la Autoridad Regulatoria Nuclear. “El resultado es bueno a nivel local, pero la enfermedad avanza independientemente de esto porque es sistémica. Una ventaja de este tratamiento es que el compuesto conteniendo Boro se concentra selectivamente en las células tumorales, de tal modo que el tejido sano recibe una dosis de radiación mucho menor. Otra ventaja es que el paciente debe ir una sola vez o dos; y no treinta o más como en la radioterapia tradicional”, compara.
Desde los primeros pasos de Marie Sklodowska Curie, pionera en el campo de la radiactividad y su aplicación en la medicina, hasta la tomografía computada, láser, acelerador de partículas, resonancia magnética o nanotecnología, entre otros, mucho se ha desandado en los últimos años, y no faltan expectativas a futuro. Hoy, casi todos en algún momento, hemos recurrido o requeriremos un físico médico aunque tal vez nunca sepamos quién es.