¿Hacia un cóctel antitumoral?
Un equipo de investigadores liderado por el profesor de Exactas-UBA Gabriel Rabinovich descubrió el mecanismo por el cual ciertos tumores no responden al tratamiento. El hallazgo no solo posibilita el desarrollo de terapias más efectivas contra esos cánceres sino, también, contra otras enfermedades.
Descargar archivo MP3 de Lino Barañao
Entrevista a Gabriel Rabinovich
Descargar archivo MP3 de Gabriel Rabinovich
Entrevista a Diego Croci
Descargar archivo MP3 de Diego Croci
Hace casi diez años, un 23 de marzo de 2004, la revista Cancer Cell, una de las publicaciones científicas más prestigiosas del mundo, titulaba en su portada “El dulce beso de la muerte” para referirse a los sorprendentes resultados de una investigación llevada a cabo por científicos argentinos.
Aquel trabajo, liderado por el doctor Gabriel Rabinovich, cordobés, investigador del Conicet y profesor en la Facultad de Ciencias Exactas y Naturales de la UBA (Exactas-UBA), había demostrado que una proteína, la Galectina 1 (Gal-1), era la responsable de que las defensas del organismo no atacaran a las células cancerosas. Los investigadores habían descubierto que la Gal-1 se une a ciertos azúcares presentes en la superficie de los linfocitos T -células encargadas de protegernos- llevándolos a la muerte. De esa manera, el tumor se deshace de la amenaza que para él significa el sistema inmune del huésped y puede seguir prosperando.
Ahora, una publicación científica aun más prestigiosa, la revista Cell, pone en tapa otro trabajo del equipo de Rabinovich que marca un nuevo hito en la lucha contra el cáncer.
La presencia del doctor Lino Barañao -Ministro de Ciencia, Tecnología e Innovación Productiva de la Nación- en la conferencia de prensa en la que se comunicó la novedad permite inferir la relevancia de la investigación.
Ciento por ciento argento
“Creo que es el artículo científico con mayor información que he visto alguna vez”, disparó Barañao en el inicio de la reunión de prensa, convocada con cierto hermetismo y respetando el horario internacional dispuesto por Cell para dar a conocer la noticia.
El encuentro fue en el Instituto de Biología y Medicina Experimental (IBYME), en Vuelta de Obligado y Monroe. “La única esquina de Latinoamérica en donde trabajaron dos premios Nobel”, consignó el ministro, para indicar que en ese lugar se habían desempeñado Bernardo Houssay y Luis Federico Leloir.
Tras resaltar la eficiencia de los investigadores argentinos –“son capaces de generar información original con recursos que a veces han sido muy exiguos”- Barañao subrayó la importancia que también tiene la eficacia: “Lograr cada tanto un hallazgo que provoca una repercusión internacional de la magnitud que tiene este trabajo”.
En otro tramo de su discurso, el ministro utilizó como ejemplo el estudio efectuado por el grupo de Rabinovich para dejar en claro lo que es “el ideal” para la política científica argentina: “Hacer ciencia básica inspirada en el uso”. Según Barañao, esa “es la manera de disolver la aparente antinomia entre aquello que tiene aplicación directa y aquello que simplemente aporta al conocimiento universal o a satisfacer la curiosidad”.
Finalmente, el funcionario informó que Rabinovich –de 45 años de edad- ya publicó 141 artículos científicos y generó ocho patentes “que son las más valiosas que tiene el CONICET”, y destacó: “La línea de trabajo de Gabriel (Rabinovich) es de su autoría. No es una línea que se ha importado, ni su laboratorio es una franquicia de un laboratorio internacional. Es una línea criolla”. Y, luego de una pausa, agregó: “Cordobesa, para más datos”, provocando la risa del público.
La gran pregunta
Como los tumores crecen muy rápidamente, para desarrollarse requieren de grandes cantidades de oxígeno. Para satisfacer esa necesidad, estimulan la formación de vasos sanguíneos –proceso denominado angiogénesis- que les provean de ese y otros nutrientes.
Los vasos sanguíneos se conforman fundamentalmente con un tipo de células, denominadas endoteliales, que crecen principalmente por la acción de una molécula denominada Factor de Crecimiento del Endotelio (VEGF, por sus siglas en inglés).
Así, cuando el VEGF se une a receptores presentes en la superficie de la célula endotelial, estimula la creación de nuevos vasos.
El descubrimiento de ese mecanismo llevó al desarrollo de un medicamento –el bevacizumab- conformado por anticuerpos anti-VEGF, que neutralizan la acción del VEGF impidiendo que se una al receptor endotelial y, por lo tanto, evitando que se formen nuevos vasos sanguíneos.
Este fármaco, aprobado por la Administración de Alimentos y Medicamentos de los Estados Unidos, ha sido efectivo para controlar un gran número de tumores.
No obstante, muchos tumores no responden a este tratamiento y otros, que en un principio responden muy bien, dejan de hacerlo después de cierto tiempo.
“La gran pregunta que nos hicimos al comenzar con este trabajo fue ¿por qué sucede esto?”, comenzó diciendo Rabinovich.
Trabajando con ratones, lograron descifrar una respuesta.
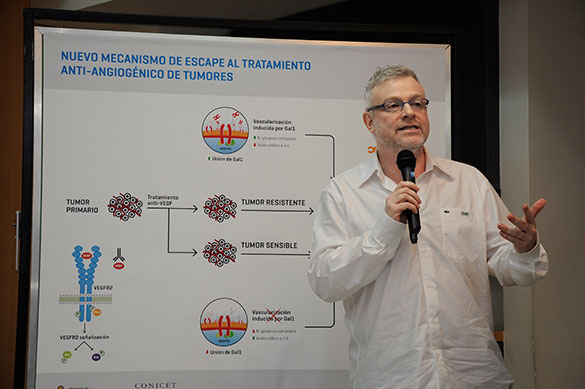
“Encontramos que cuando se bloquea al VEGF entra en acción la Galectina 1 producida por las células tumorales, que se une a los mismos receptores a los que se unía el VEGF y realiza la misma función. Es decir, estimula el crecimiento de los vasos sanguíneos y permite que el tumor siga creciendo”.
La particularidad de esta “angiogénesis compensatoria” (así la denominan) es que si bien la Gal-1 se une al mismo receptor –y cumple la misma función- que el VEGF, la unión de la Gal-1 -a diferencia del VEGF- se efectúa a través de ciertos azúcares que están unidos a ese receptor.
“Comprobamos que los tumores que son refractarios al tratamiento con anti-VEGF son aquellos en los que los receptores exponen libremente esos azúcares, lo que permite que la Gal-1 se una a ellos sin inconvenientes y estimule la angiogénesis”, explica Rabinovich, y completa: “En cambio, en los tumores donde funciona perfectamente el tratamiento anti-VEGF porque no hay angiogénesis compensatoria, lo que sucede es que los azúcares a los cuales se une la Gal-1 no están libres, sino que están cubiertos por un “escudo” de ácido siálico, que es otro tipo de azúcar, que evita la unión de Gal-1 y, por lo tanto, no se forman nuevos vasos sanguíneos”.
Hasta llegar a ser publicado en Cell, el trabajo argentino sobrellevó numerosas idas y vueltas, porque los referís que lo evaluaban sugerían nuevos experimentos. “El artículo lo enviamos por primera vez en el año 2010”, cuenta Rabinovich.
No obstante, durante esos años de expectativa no se quedaron de brazos cruzados: “Mientras esperábamos, pensamos en crear una alternativa al tratamiento con anti-VEGF y fue así que hace unos años desarrollamos un anticuerpo anti-Galectina-1”, comenta, y revela: “Lo aplicamos a ratoncitos que tenían tumores refractarios al tratamiento con anti-VEGF y logramos revertir esa refractariedad, porque con el anticuerpo secuestramos a la Gal-1 y entonces impedimos la angiogénesis compensatoria”.
En otro tramo de su exposición, Rabinovich expuso otro resultado –que consideró “muy interesante”- de sus numerosos experimentos: “Vimos que cuando aplicamos el anticuerpo anti-Gal1 los vasos sanguíneos que rodean el tumor de manera caótica empiezan a hacerse muy parecidos a los normales. Este proceso de normalización es muy importante, porque permite que las células antitumorales del sistema inmunológico del ratón puedan migrar a través de esos vasos sanguíneos y llegar al tumor para matarlo”, aclara.
Carrera contra el tiempo
Luego de la conferencia, en un aparte con este cronista, Gabriel Rabinovich opinó sobre las alternativas terapéuticas que brindan los anticuerpos: “Yo creo que ante la posibilidad de que aparezcan estos mecanismos compensatorios que generan tumores resistentes a los tratamientos, lo importante es hacer cócteles. Así como los cócteles funcionaron perfectamente para la infección por HIV, creo que para el tratamiento del cáncer también va a aparecer la idea de los cócteles. Lo que imaginamos es un cóctel donde estén estos dos anticuerpos, anti-VEGF y anti-Gal-1, de manera de poder bloquear en diferentes puntos la vascularización de los tumores. Y cuando hay resistencia a un determinado anticuerpo utilizar otros anticuerpos, que bloqueen la angiogénesis o que estimulen la respuesta inmune”.
En uno de los párrafos del artículo publicado en Cell, se señala que “estos hallazgos pueden tener implicancias más extensas en otros escenarios clínicos”. Al respecto, Rabinovich amplía: “La posibilidad de modular el desarrollo de los vasos sanguíneos es útil para toda enfermedad en la cual la angiogénesis aberrante sea un mecanismo patogénico de la enfermedad. Esto sucede en la retinopatía diabética, en la degeneración macular y en las enfermedades cardiovasculares. En este último caso, por ejemplo en un infarto de miocardio en el que se produce un déficit de oxígeno en el tejido cardíaco, podría tratarse con Galectina-1 que estimula la angiogénesis”.
Con indisimulable humildad, el investigador considera que el trabajo realizado por su equipo es apenas “una herramienta más” en un contexto que, todavía, está signado por el tiempo de sobrevida que se le puede dar a un paciente: “En cáncer se trata de ir ganando tiempo”, concluye.
Autores y financiación
El trabajo publicado en Cell lleva como primer autor al doctor Diego Croci -del Laboratorio de Inmunopatología del IBYME, que es lugar donde se desarrolló la investigación- pues gran parte de los resultados formaron parte de su tesis doctoral y de sus trabajos de posdoctorado.
También firman el estudio Juan Cerliani, Tomás Dalotto-Moreno, Santiago Méndez-Huergo, Iván Mascanfroni, Sebastián Dergan-Dylon, Marta Toscano, Julio Caramelo, Juan García-Vallejo, Jing Ouyang, Enrique Mesri, Melissa Junttila, Carlos Bais, Margaret Shipp, Mariana Salatino y Gabriel Rabinovich.
Los fondos que posibilitaron este desarrollo provienen enteramente de fuentes nacionales: la Agencia Nacional de Promoción Científica y Tecnológica, el CONICET, la Universidad de Buenos Aires, la Fundación Sales y las familias Ferioli y Ostry.