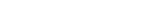Inactivar, esa es la cuestión
Dos equipos de investigación procuran resolver, con distintas técnicas, el cuello de botella que significa la extracción de ARN en la detección del SARS-CoV-2. Enriquecidas por el intercambio de información entre ambos grupos de trabajo, las propuestas apuntan a la inactivación del virus tras el hisopado, para acelerar y abaratar el procedimiento.

El trabajo de ambos equipos apunta a facilitar, en términos de tiempo y de disponibilidad de recursos, los procedimientos que se utilizan en el país para detectar al SARS-CoV-2.
“Desde el primer momento apuntamos a que esto sea lo más rápido, sencillo y barato posible. La idea es ganar tiempo y federalizar”, dice el biólogo Manuel Muñoz, uno de los integrantes del grupo que lidera Alberto Kornblihtt en el Instituto de Fisiología, Biología Molecular y Neurociencias (IFIBYNE, UBA-CONICET) e ilustra con precisión la búsqueda que desde marzo desvela a los investigadores del sistema científico argentino: facilitar, en términos de tiempo y de disponibilidad de recursos, los procedimientos que se utilizan en el país para detectar al SARS-CoV-2, el virus causante de la pandemia que cambió el rumbo planetario.
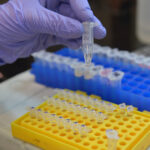
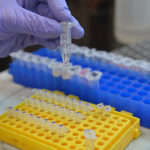
Dos investigaciones desarrolladas en paralelo por científicos y científicas de la Facultad de Ciencias Exactas y Naturales de la UBA, pero que mantienen un permanente intercambio de información, procuran resolver, con diferentes técnicas, un mismo dilema: el de sortear el evidente cuello de botella que supone, entre el hisopado para obtener las muestras y su posterior análisis por PCR (reacción en cadena de la polimerasa), el proceso de extracción de ARN.
“Es un procedimiento muy laborioso, que lleva muchísimo tiempo y que, además, es caro, porque requiere kits importados. Para analizar la cantidad de muestras que van en una plaquita de PCR se necesita alrededor de seis horas de trabajo de un técnico, con un costo por extracción de unos seis dólares. El objetivo era hacerlo más barato y más rápido”, resume Valeria Levi, docente del Departamento de Química Biológica de Exactas UBA e investigadora en el IQUIBICEN (UBA-CONICET).
La investigación que Levi conduce junto a su colega Valeria Genoud surgió a partir del preprint (el trabajo previo a la publicación en una revista con referato) de un investigador sueco, Björn Renius, del Instituto Karolinska, que en abril había postulado la posibilidad de inactivar el virus mediante un tratamiento térmico, sin recurrir a la extracción de ARN.
“Lo leímos, le escribimos inmediatamente y, muy generosamente, nos dijo que habían avanzado respecto de lo publicado en el preprint y nos envió toda la información –cuenta Levi–. Además de la inactivación térmica, agregamos un tratamiento enzimático, con muy buenos resultados, y así llegamos a un protocolo optimizado. Lo que se elimina es el paso inicial del procedimiento estándar, que es purificar el ARN, que puede parecer trivial pero es el más engorroso y es lo que está dificultando el ritmo de los testeos. Entonces, la muestra directamente se inactiva y se lleva inactivada al equipo de PCR, de acuerdo a un protocolo que demandaría solo 30 minutos y costaría solo 0,6 dólares”.
Levi, Genoud y su equipo realizaron la semana pasada el primer ensayo con insumos locales (una enzima de fabricación nacional), también con resultados positivos. Los validaron en el laboratorio y en un hospital de la Provincia de Buenos Aires, con unas 350 muestras analizadas, y ya vislumbran la posibilidad de transferir la tecnología a través del Ministerio de Ciencia y el CONICET.
Valeria Genoud participa de la entrevista pero vía Zoom, desde un operativo del plan DetectAr en la localidad bonaerense de San Justo. “Queremos verificar que nuestro método de inactivación también funciona con saliva. Si bien el método estándar de detección es nasofaríngeo, en todo el mundo se está tratando de hacer las determinaciones por saliva, por dos razones: es menos invasivo y además no expone tanto al personal de salud”, explica mientras camina por las calles de La Matanza, y aclara: “Todas estas muestras van directo al INBIRS, en la Facultad de Medicina de la UBA, donde se las procesa. A Exactas solo entran las muestras ya inactivadas, y ahí hacemos el PCR de material biológico no infectivo”.
El Instituto de Investigaciones Biomédicas en Retrovirus y Sida (INBIRS, UBA-CONICET) es uno de los actores centrales en el diagnóstico de SARS-CoV-2 en el país, y su colaboración es vital para potenciar tanto la investigación del IQUIBICEN como la que se desarrolla en el IFIBYNE, que también busca, con una aproximación experimental distinta, aportar soluciones originales que permitan eludir el embrollo de la extracción de ARN.
“Nuestro principal objetivo era lograr que los laboratorios de investigación básica, como los nuestros, pudieran participar de las tareas de diagnóstico. Por un relevamiento que hizo CONICET sabíamos que había unos 100 equipos que se podían usar para hacer PCR para detección. Entonces, dijimos, sería clave tener un protocolo de trabajo que le permitiera a esos laboratorios, que no tienen cabinas de bioseguridad de nivel 3, poder hacer detección de SARS-CoV-2”, explica el biólogo Ezequiel Petrillo, quien coordina las acciones del equipo del IFIBYNE.
“La idea –añade Petrillo– era obtener un método casero de preparación de las muestras, y cuando digo casero, me refiero a un método rápido que no utilice kits ni insumos importados onerosos y difíciles de conseguir, que contemplara como primer paso la inactivación de esas muestras, es decir, que cualquier patógeno presente en ellas muera o, en el caso de los virus, quedara inactivado, de modo que quien después maneje esa muestra tenga bajo riesgo de infección.”
Aquí, el mecanismo inactivador del virus no lo propuso un investigador sueco sino uno suizo, Fabian Rudolf, de la Eidgenössische Technische Hochshule (ETH), de Zurich. “Habíamos probado diversas metodologías de extracción de ARN, hasta que dimos con el trabajo de este colega, que había propuesto una opción similar en 2006, cuando en Suiza hubo un brote de un virus que ataca a las vacas. Desarrolló una solución que permitía inactivar los patógenos de las muestras logrando, además, que fueran estables a temperatura ambiente durante mucho tiempo”, explica Petrillo.
Inspirada en la de Rudolf, la solución formulada y testeada en el IFIBYNE “tiene una alta concentración de agentes caotrópicos –describe Manuel Muñoz–, que desestabilizan la estructura del virus, a lo que se suma la acción del calor, inactivándolo, de modo que ese material puede ser tratado sin riesgo para el operario, sin necesidad de un nivel 3 de bioseguridad”.
Ocho minutos demanda la inactivación de la muestra obtenida por hisopado, incubada en la solución a 98°C o en agua hirviendo. “De eso se toma una alícuota y se pasa a otro tubo donde hay una resina que quita los inhibidores que puedan venir con la muestra”, puntualiza Petrillo. Otros cinco minutos de incubación y la muestra, ya inactivada, está lista para el análisis de PCR, según el procedimiento estándar, o para NEOKIT-COVID-19 o ELA-Chemstrip (los tests rápidos desarrollados en el Instituto Milstein y en las Universidades de San Martín y Quilmes) o cualquier otro kit diagnóstico.
“Idealmente –concluye Petrillo–, el operario que realiza el hisopado tira el hisopo en nuestra solución, lo pasa por agua hirviendo y puede mandarlo a que se analice, con la capacitación adecuada, en cualquier laboratorio, inclusive en unidades móviles de diagnóstico, en un camión sanitario del plan DetectAr o en un carpa en la estación Constitución”.
No se trata de desarrollos complementarios, pero el flujo de información entre ambas iniciativas ha ido enriqueciéndolas. El método de inactivación viral del IQUIBICEN apunta a optimizar –acelerando los procesos y abaratando los costos, sin afectar sustancialmente la sensibilidad de la detección– la tarea de los laboratorios que ya realizan diagnóstico de SARS-CoV-2. El del IFIBYNE, a ampliar la capacidad diagnóstica a un centenar de laboratorios y lugares con escaso equipamiento, resignando algo de sensibilidad –pues la muestra se diluye– pero disminuyendo notablemente los requerimientos de bioseguridad al inactivarla inmediatamente después de la toma. En uno y otro, se economizan recursos materiales y humanos y, sobre todo, se gana tiempo en una carrera contrarreloj frente a la pandemia.
Los equipos de investigación
Grupo de trabajo IFIBYNE: Alberto Kornblihtt, Ezequiel Petrillo, Manuel Muñoz, Ignacio Schor, Anabella Srebrow, Manuel de la Mata, Valeria Buggiano, José Clemente, Micaela Godoy Herz, Nicolás Nieto Moreno, José Stigliano, Laureano Bragado, Marcos Palavecino, Lucas Servi, Federico Fuchs y Juan C. Muñoz; además de Cybele García, del IQUIBICEN, y Fabian Rudolf, del ETH-Zurich.
Grupo de trabajo del Departamento de Química Biológica/IQUIBICEN: Valeria Levi, Valeria Genoud, Martín Stortz, Virginia Dansey, Paula Verneri, Bruno Berardino y Ariel Waisman, de FLENI. En el INBIRS: Federico Remes-Lenicov y Gonzalo Cabrerizo.