Superantibióticos
Mientras crecen las muertes por la aparición de bacterias resistentes a los antibióticos, un grupo de investigación diseñó una estrategia original que podría ser útil para luchar contra esos supermicrobios.
Es una de las diez principales amenazas de salud pública a las que se enfrenta la humanidad, según la Organización Mundial de la Salud (OMS). Actualmente, se lleva la vida de cientos de miles de personas de todo el planeta y se predice que, para 2050, será la primera causa de muerte en el mundo. No obstante, se habla muy poco de esta cuestión en los medios de comunicación. Por eso, muchos especialistas dicen que se trata de una “pandemia silenciosa”.
Estamos refiriéndonos a la resistencia a los antimicrobianos, un problema sanitario creciente -causado, mayormente, por el uso indebido y excesivo de antibióticos en la práctica médica y veterinaria- que está generando “supermicrobios”, es decir, bacterias, virus, parásitos y hongos resistentes a la gran mayoría de –si no a todos- los medicamentos disponibles para tratar las infecciones que provocan estos patógenos.
A este problema, se debe añadir otro: hay muy pocos ensayos clínicos en desarrollo para probar nuevos antibióticos, porque para la industria farmacéutica no resulta rentable invertir en drogas que pueden dejar de ser efectivas en tiempos relativamente cortos.
Hay muy pocos ensayos clínicos en desarrollo para probar nuevos antibióticos porque a la industria farmacéutica no le resultan rentables.
En este contexto, la OMS sugiere a los Estados la instrumentación de políticas que ayuden a prevenir y controlar la generación de supermicrobios. En 2022, con la sanción de la ley 27.680, la Argentina se convirtió en el primer país de la región que dispuso de una norma destinada a promover el uso responsable de antibióticos y a regular su utilización y expendio. De hecho, para comprar estos medicamentos ahora se requiere, al igual que para los psicotrópicos, de la receta duplicada.
Así las cosas, un equipo de investigación diseñó una estrategia original para potenciar la acción de los antibióticos y que, por lo tanto, podría ser útil para luchar contra los supermicrobios. El trabajo se dio a conocer en la revista científica Proceedings of the National Academy of Sciences (PNAS), una de las publicaciones más valoradas en el mundo de la ciencia.
Sinergia antibiótica
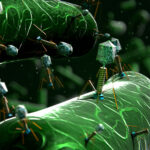
En las últimas décadas, nanotecnologías mediante, se han desarrollado métodos para encapsular medicamentos dentro de partículas microscópicas y, de esta manera, dirigir el fármaco al sitio del organismo donde se lo quiere hacer actuar y, también, regular la velocidad con la que se libera el medicamento en ese lugar.
“Lo novedoso de nuestro trabajo es que encapsulamos un antibiótico dentro de un agente encapsulante que también tiene actividad antibiótica y, además, demostramos que esas nanoestructuras tienen una actividad biológica sinérgica”, revela Mario Tagliazucchi, investigador del CONICET en el Instituto de Química Física de los Materiales, Medio Ambiente y Energía (INQUIMAE) y uno de los autores del trabajo publicado en PNAS.
Tagliazucchi, que es profesor de la Facultad de Ciencias Exactas y Naturales de la UBA, viene trabajando con su equipo del INQUIMAE en esta línea de investigación junto con el grupo de Martin Conda-Sheridan, un científico argentino que trabaja en la Universidad de Nebraska, en los Estados Unidos.
Ambos grupos decidieron juntarse para colaborar en el estudio de los péptidos anfifilos (PAs) como agentes encapsulantes: “Son moléculas promisorias para abordar el problema de la resistencia microbiana a los antibióticos porque atacan la membrana bacteriana y la rompen”, explica Tagliazucchi, y agrega: “En un trabajo previo, nosotros encontramos que estas moléculas podían encapsular ciertas sustancias, entonces decidimos ver si podíamos usar estos péptidos para encapsular antibióticos y si, de esta manera, podíamos lograr una acción sinérgica”.
Probaron dos estrategias distintas. Por un lado, usaron una sustancia antibiótica encapsulada dentro de los PAs. Por otro lado, usaron los PAs y el antibiótico combinados, es decir, sin encapsular. La sustancia antibiótica que utilizaron para los experimentos solamente es efectiva contra un grupo de bacterias, las llamadas “gram+”, porque en las gram- no puede atravesar la pared bacteriana e ingresar.
Lo novedoso de este trabajo es que el equipo encapsuló un antibiótico dentro de un agente encapsulante que también tiene actividad antibiótica.
Después, compararon ambas estrategias con bacterias gram+ y gram-: “Tanto la encapsulación como la combinación funcionaron bien para atacar a ambos tipos de bacterias. Es decir, en ambos casos comprobamos una acción sinérgica entre las dos moléculas porque, en ambos tipos de bacterias, el péptido anfifilo genera poros por donde el antibiótico puede penetrar. En definitiva, el resultado es un efecto antibiótico de amplio espectro”, resalta.
Si bien las dos estrategias fueron efectivas, la encapsulación genera más expectativas en el equipo de investigación por la posibilidad que ofrece de controlar la velocidad de liberación del antibiótico encapsulado lo que, a su vez, podría ser clave para mantener una concentración terapéutica efectiva y reducir la toxicidad. De hecho, en el trabajo publicado en PNAS probaron la estrategia de encapsulación en un modelo que permite estudiar la actividad antibacteriana in vivo. Para ello, utilizaron larvas que habían sido previamente infectadas con una bacteria gram-. “En los estudios in vivo, nuestra estrategia de encapsulación mostró mejor eficacia antibiótica que la polimixina B, un antibiótico que actúa contra los gérmenes gram-”, informa Tagliazucchi.
Aunque todavía queda muchísimo camino por recorrer, el estudio representa un avance significativo en la lucha contra la resistencia antimicrobiana: “Yo creo que acá lo interesante es la estrategia de combinar dos antibióticos encapsulando uno dentro del otro, eso es nuevo, eso no se ha hecho”, destaca Tagliazucchi. “Los resultados que obtuvimos son muy promisorios, pero son sistemas muy complejos y todavía tenemos mucho por entender sobre su funcionamiento”, concluye.
Los autores del trabajo publicado en PNAS son Huihua Xinga, Luana Janaína de Campos, Aramis Jose Pereira, Maria Mercedes Fiora, Fabio Aguiar-Alvese, Mario Tagliazucchi y Martin Conda-Sheridan.