El molde para fabricar proteínas
Para que una célula pueda producir una proteína, debe entrar en acción una compleja maquinaria encargada de poner a punto la molécula de ARN mensajero que opera como molde. Ahora, una investigación describe por primera vez cómo las proteínas involucradas en esa puesta a punto, al ser modificadas por otras moléculas, influye en la eficiencia con que se realiza el proceso.
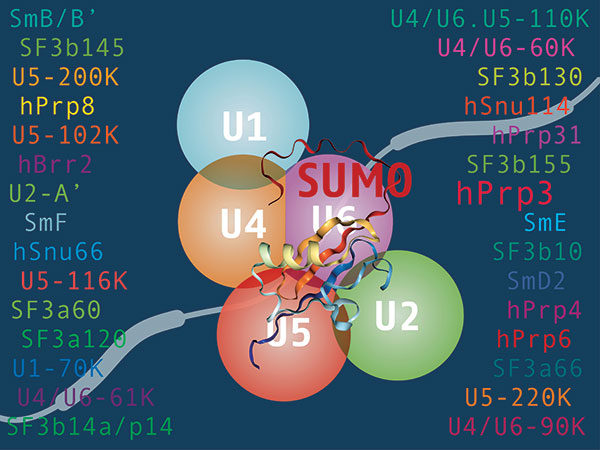
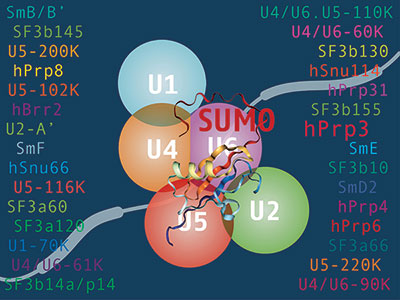
Ilustración realizada por Luciana Giono (investigadora del IFIBYNE, UBA-CONICET) publicada en la tapa de la revista Nucleic Acids Research.
http://nexciencia.exactas.uba.ar/audio/AnabellaSrebrow.mp3
Descargar archivo MP3 de Anabella Srebrow
El poder ya no reside exclusivamente en los genes. Hace algunos años, cuando la meta era descifrar el genoma humano y el de otros organismos, se pensaba que los genes tenían la clave de la vida y, por ende, de la salud y la enfermedad. Asimismo, se creía que la complejidad de ciertos organismos, como el humano, se debía a una mayor cantidad de genes. Pronto se vio que el genoma de los humanos y los primates, e incluso, el de ciertos gusanos, tenían un número de genes muy similar. Entonces la clave debía estar en otro lado, no ya en el ADN, sino en el ARN, un grupo de moléculas entre las que se encuentra el ARN mensajero que es el molde en el que se transcribe la información genética para poder sintetizar proteínas.
Pero pronto se vislumbró la complejidad de la maquinaria que pone a punto ese molde de ARN mediante el corte y empalme de fragmentos. Es más, ahora fue posible desentrañar algunos engranajes de ese complejo accionar. Así, un equipo de investigadores de la Facultad de Ciencias Exactas y Naturales de la UBA demostró que cierta modificación en algunas proteínas que intervienen en el armado del molde (ARN mensajero) influye en la eficiencia de ese mecanismo. Si la modificación no se produce, o se realiza de manera anómala, el proceso de corte y empalme se ve impedido.

Anabella Srebrow. Foto: Exactas-Comunicación.
“Demostramos que cierta modificación de algunas de las proteínas componentes del sistema de corte y empalme (splicing) de ARN, que se denomina spliceosoma, afecta el proceso de splicing”, afirma Anabella Srebrow, investigadora del Instituto de Fisiología, Biología Molecular y Neurociencias (IFIBYNE, UBA-CONICET) y profesora del Departamento de Fisiología, Biología Celular y Molecular de Exactas UBA.
La modificación en cuestión es el agregado de una pequeña proteína denominada SUMO. Se sabía que ese cambio se producía, pero se desconocía su importancia para el funcionamiento del spliceosoma. “Nosotros mostramos que si esa modificación se ve afectada, se altera el proceso de corte y empalme del ARN mensajero que sirve de molde para la síntesis de proteínas”, confirma la investigadora.
Proceso indispensable
La puesta a punto de la molécula de ARN mensajero es indispensable para la fabricación de proteínas en el citoplasma de la célula. En el núcleo celular, a través del proceso de transcripción, la información de los genes se transcribe a una molécula de ARN, pero esta molécula tiene que estar debidamente acondicionada como para pasar al citoplasma y servir de molde. Para ello debe realizarse un proceso de corte y empalme, o splicing, a través del cual se eliminan ciertas porciones del ARN que carecen de información para la fabricación de las proteínas.
“Ese proceso de splicing es complejo, porque hay que cortar pedazos y volver a unir, es como un trabajo de sastre. Esa tarea es realizada por una maquinaria muy compleja, que se llama spliceosoma”, explica Srebrow.
Esa maquinaria tiene muchos componentes: proteínas y moléculas pequeñas de ARN. “Lo que estudiamos son algunas modificaciones que sufren las proteínas que componen la maquinaria, durante la reacción de splicing”, acota la investigadora.
En general, todas las proteínas pueden ser modificadas mediante el agregado de otras moléculas. Esos agregados son indispensables para que la proteína cumpla su función dentro de la célula.
Una de esas modificaciones es el agregado de la proteína SUMO. El trabajo que se publica en Nucleic Acids Research “describe por primera vez que las proteínas del

Laureano Bragado, Anabella Srebrow, Berta Pozzi y Pablo Mammi. Foto: Exactas-Comunicación.
spliceosoma, al ser modificadas con las moléculas de SUMO, hacen que el proceso de splicing se realice de manera diferente, con mayor o con menor eficiencia”, detalla Berta Pozzi, primera autora del trabajo que también suscribe Laureano Bragado (tesista doctoral). Ambos son becarios del CONICET en el IFIBYNE.
Por su parte Srebrow comenta: “Ya se conocía que muchas proteínas del splicesoma eran modificadas por la conjugación de SUMO, pero no se sabía si eso tenía alguna consecuencia sobre el proceso de splicing”.
Mayor eficiencia
Los investigadores, en sus experimentos in vitro, emplearon un precursor modelo (un fragmento de ARN), que, en presencia de la maquinaria de splicing, sufre un tipo de corte y empalme determinado. Para ese precursor, encontraron que el agregado de SUMO era necesario para que el proceso se llevara a cabo y se obtuviera el producto final: el ARN listo como molde.
Algunos de los experimentos se realizaron con un extracto del núcleo celular, donde se observaba de qué manera el ARN mensajero pasaba de ser un largo fragmento aún inmaduro, al producto final, el ARN que ya había sufrido el corte y empalme.
Otros experimentos se efectuaron con un cultivo celular, donde se observó cómo, favoreciendo el agregado de SUMO a las proteínas del spliceosoma, la cantidad de ARN maduro aumentaba en relación con las células en las cuales esa modificación no se producía.
“Vimos que si, in vitro, uno altera en forma masiva la modificación de proteínas del spliceosoma, evitando el agregado de SUMO, se altera la eficiencia del proceso”, relata Pozzi y detalla: “Introdujimos en la célula una proteína mutada, a la cual no se le pueden adosar las moléculas de SUMO. Así pudimos comparar qué pasa en la célula cuando se produce el agregado de SUMO, y cuando este agregado no se realiza”.
Mutaciones y enfermedad
La importancia del hallazgo reside, precisamente, en que algunas enfermedades se vinculan a mutaciones en los genes a partir de los cuales se fabrican las proteínas del spliceosoma; por ejemplo, algunos tipos de leucemia, y una enfermedad de la retina, la retinitis pigmentosa. En estas patologías, el splicing es defectuoso.
Lo cierto es que los genes ya no detentan todo el poder. Lo comparten con las proteínas. Si estas son modificadas o no por el agregado de otras moléculas, ello puede dar lugar a diversas patologías.
“Ahora, además del ADN y el ARN, el poder parecen tenerlo las proteínas, estas poseen una gran diversidad, que en parte se logra a través de su modificación por el agregado o remoción de moléculas. Así se va ampliando la capacidad de un genoma, que con un número limitado de genes da lugar a un número muy amplio de proteínas, a través de estos procesos intermedios que ocurren entre la información que está en el gen, y la actividad que va a llevar a cabo cada proteína”, concluye Srebrow.