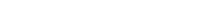El día de las madres
El británico John Gurdon y el japonés Shinya Yamanaka fueron galardonados por la Academia Sueca por sus investigaciones en el campo de las células madre. El trabajo de ambos científicos permite que hoy se pueda reprogramar una célula madura para convertirla en pluripotente, es decir, capaz de generar cualquier tipo de tejido, lo cual posibilitará el tratamiento de diversas enfermedades

El premio Nobel de Medicina fue para John Gurdon y Shinya Yamanaka.
Entrevista a Alejandra Guberman
Descargar archivo MP3 de Alejandra Guberman1
Entrevista a Alejandra Guberman
Descargar archivo MP3 de Alejandra Guberman2
En el mundo de la ciencia algunas verdades tienen patas cortas. Puede suceder que un paradigma sea refutado y reemplazado por uno nuevo.
Una muestra de este desmoronamiento de certezas ocurrió en 1962, cuando John Gurdon desafió un dogma reinante hasta ese entonces, que sostenía que la especialización celular era un proceso irreversible. Es decir, que una vez que una célula inmadura se transformaba en muscular, nerviosa u ósea no había vuelta atrás.
Gurdon planteó la hipótesis de que las células de los diferentes tejidos mantenían en su ADN las instrucciones para transformarse en cualquier tipo celular. Y lo demostró mediante un experimento con la rana Xenopus laevis: tomó un huevo de este animal y reemplazó su núcleo por el núcleo de una célula especializada (del intestino) de un renacuajo de la misma especie. Ese huevo con el núcleo de la célula intestinal se desarrolló y originó un renacuajo.
Así, Gurdon le mostró al mundo que el núcleo de una célula madura puede ser reprogramado para generar los distintos tipos celulares que conforman un organismo. En otras palabras, que una célula especializada puede revertir el proceso de diferenciación y volver a ser pluripotente, como algunas células madre.
El hallazgo de Gurdon, inicialmente mirado con escepticismo por sus colegas de la época, fue reconocido este año con el premio Nobel de Medicina.
Además, la técnica empleada para sus experimentos sentó las bases para el desarrollo de la metodología que permitió el clonado de la oveja Dolly en 1996.
Parir madres
Debieron pasar más de 40 años desde el descubrimiento de Gurdon para que Shinya Yamanaka se preguntara si era posible revertir el proceso de diferenciación en una célula madura -volver a hacerla inmadura, pluripotente, capaz de generar cualquier tipo de tejido- sin tener que trasplantar su núcleo a otra célula. Es decir, trabajando con la célula íntegra.
Para encontrar una respuesta, Yamanaka analizó detenidamente el conocimiento que se tenía a principios de este siglo acerca de cuáles eran los genes que, se suponía, mantenían a las células madre embrionarias en estado pluripotente.
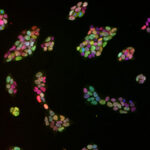
Seguidamente, seleccionó 24 de estos genes, los introdujo en células especializadas (fibroblastos) obtenidas de la piel del ratón y observó que dichos fibroblastos adquirían propiedades prácticamente idénticas a las de las células madre embrionarias.
Dedujo entonces que, entre esos 24 genes, estarían los responsables de inducir el estado pluripotente en una célula.
Con ese dato, inició una serie de experimentos, reduciendo uno por uno el número de genes transferidos a los fibroblastos y probando distintas combinaciones de dichos genes, hasta que encontró el mínimo número de genes suficiente para convertir un fibroblasto de ratón en una célula madre pluripotente.
Finalmente, en 2006 Yamanaka publicó el resultado de tan ardua búsqueda: solo hacían falta cuatro genes para “fabricar” una célula madre a partir de una célula de la piel. Un trabajo que le valió el Nobel de Medicina 2012.
Madres del futuro
En los pocos años que pasaron desde el logro de Yamanaka, los avances en el campo de estas células madre pluripotentes inducidas (IPS, por sus siglas en inglés) fueron notables.
“Actualmente, se pueden generar IPS sin necesidad de incorporar genes, sino agregando ARN o proteínas que tienen una vida media muy corta y que, por lo tanto, una vez que revirtieron el proceso de diferenciación desaparecen. Esto tiene la ventaja de que no se modifica el genoma de la célula”, ilustra la doctora Alejandra Guberman, investigadora del Conicet en el Laboratorio de Regulación Génica en Células Madre, de la Facultad de Ciencias Exactas y Naturales de la UBA.
La posibilidad de generar células madre a partir de, por ejemplo, un fragmento de piel abre un camino promisorio en el campo de la salud. “Se espera que las IPS puedan servir para tratar ciertas enfermedades en las que hay daño de algún tejido, como el infarto de miocardio o la diabetes, entre otras”, indica Guberman.
Con respecto a la ventaja que supondría reparar un tejido con células del propio cuerpo, pues se evitaría el rechazo inmunológico, Guberman advierte: “Obtener IPS listas para trasplantar lleva mucho tiempo y mucho dinero. No creo que, a corto plazo, se puedan hacer para cada paciente. Lo que sí se podría hacer es un banco de IPS donde esté representada toda la población en el que se podría encontrar un tejido compatible”.
Por otra parte, el procedimiento inaugurado por Yamanaka resolvería los conocidos problemas éticos que conlleva el uso de células madre embrionarias. “Si bien ambas son pluripotentes, las IPS no son idénticas a las células madre. Tienen diferencias en algunos detalles moleculares”, aclara Guberman.
“De todos modos, no hace falta que sean absolutamente idénticas, lo que sí es necesario es que esas células producidas en el laboratorio puedan generar cualquier tipo de tejido”, opina.